THERMOMÈTRES GÉOLOGIQUES ou GÉOTHERMOMÈTRES
Article modifié le
Utilisation des états d'équilibre figés
L'hypothèse de base est la suivante : la roche était en équilibre thermodynamique à une certaine température T. À partir de cette température, le refroidissement a été suffisamment rapide pour empêcher tout réarrangement de l'édifice minéral. Par conséquent, l'étude du système figé doit fournir les paramètres physiques relatifs à l'équilibre, et en particulier la température T.
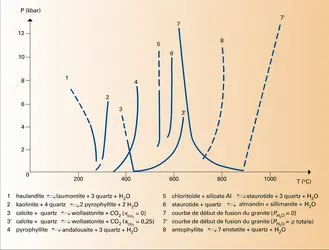
Le principal écueil est que ces paramètres sont souvent assez nombreux. La plupart des associations minérales que l'on rencontre dans les roches sont des systèmes au moins bivariants, c'est-à-dire que leur existence indique seulement un certain domaine de températures et de pressions (une certaine surface dans le plan P-T). Il existe cependant un certain nombre d'équilibres univariants, par exemple ceux qui sont liés à l'apparition ou à la disparition de certains minéraux dans le métamorphisme.
Ces réactions qui correspondent aux isogrades permettent d'établir une relation T = f (P) [une courbe dans le plan P-T] ; cependant, comme la pression n'est généralement pas déterminable indépendamment, cela ne permet pas d'en déduire la température. La pente de la tangente à la courbe d'équilibre est la relation de Clapeyron :
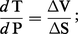
Deux cas limites sont intéressants pour la paléothermométrie.
Si la transformation envisagée produit un liquide ou un gaz, il y a généralement un accroissement important aussi bien du volume que de l'entropie. C'est, par exemple, le cas des réactions de déshydratation telles que :
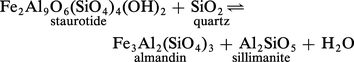
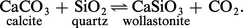
Alors, pour un certain domaine de pressions « moyennes » (de 1 à 7 kbar, soit de 100 à 700 MPa), variables avec la réaction considérée, la variation d'entropie l'emporte largement sur la variation de volume, et l'on a :
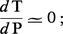
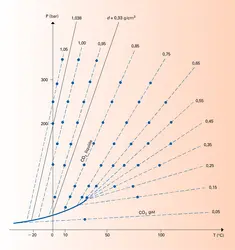
Lorsque la transformation se produit avec une variation de volume négligeable, on a encore :
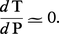
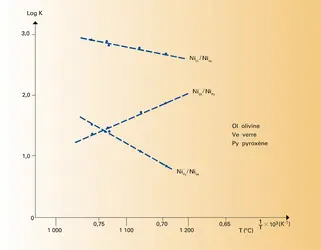
Cela se produit en pratique dans deux cas importants : – Un élément se partage entre deux phases solides. La variation relative de volume est alors souvent très faible et, comme les volumes molaires des solides sont eux-mêmes faibles, on aboutit à un ΔV négligeable par rapport à ΔS. Cela est particulièrement intéressant quand l'élément en question est un élément en traces qui ne conditionne pas l'existence ou la disparition d'une phase. Alors, les bilans de matière sont très simples à écrire et l'équilibre de partage se traduit très facilement.
– Les propriétés du soluté sont suffisamment voisines de celles du solvant pour que la solution soit quasi idéale quelle que soit la concentration. C'est typiquement le cas des mélanges d'isotopes des éléments, qui, de plus, peuvent généralement être considérés aussi comme le partage d'un élément en traces, car l'un des isotopes est le plus souvent nettement[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Marc JAVOY : physicien adjoint à l'Institut de physique du globe de l'université de Paris-VI
Classification
Médias
Autres références
-
FELDSPATHS
- Écrit par Jean-Paul CARRON
- 4 817 mots
- 9 médias
Le coefficient de partage du sodium entre un feldspath alcalin et un plagioclase a été à l'origine d'un des premiers exemples dethermométrie géologique. Le diagramme de Barth (fig. 7), établi à partir de considérations pétrographiques et théoriques, a été précisé par des études expérimentales, et... -
MAGNÉTITE
- Écrit par Yves GAUTIER
- 1 139 mots
- 1 média
Oxyde de fer, la magnétite (du grec magnès, aimant) doit son nom à sa principale caractéristique : c'est un aimant naturel. La forme de ses cristaux permet également de la distinguer aisément, ceux-ci se présentant généralement en octaèdres, en dodécaèdres ou en rhomboèdres parfaits, dérivant...
-
MINÉRALOGIE
- Écrit par Claude GUILLEMIN
- 11 987 mots
- 22 médias
...température donnera par exsolution des associations orientées d'albite et de feldspath potassique K[AlSi3O8], connues sous le nom de perthites. La température d'exsolution donne ainsi une limite inférieure de température de formation de l'association étudiée ( thermomètre géologique). -
NUCLÉAIRE (PHYSIQUE) - Isotopes
- Écrit par René BIMBOT et René LÉTOLLE
- 5 402 mots
- 1 média
...eau-phosphate, eau-sulfate ont donné lieu à de nombreux travaux qui ont abouti à des relations précises entre les compositions isotopiques des divers constituants. Ces relations sont dépendantes de la température. On a pu ainsi mettre au point des méthodes « paléothermométriques » (H. Urey, 1947), d'usage désormais...
Voir aussi