ZINC
Article modifié le
Le zinc (symbole Zn, numéro atomique 30) est un élément chimique métallique blanc bleuâtre appartenant au sous-groupe II b de la classification périodique. Quoiqu'il soit de grande consommation et que ses applications se rencontrent dans la vie courante, il est peu connu. Le zinc est cité pour la première fois sous sa dénomination actuelle par Paracelse dans son traité De re metallurgica, au début du xvie siècle. Son exploitation industrielle a commencé en Angleterre en 1740.
Métallurgie
Les minerais de zinc se trouvent dans la nature sous deux formes principales : d'une part, les variétés sulfurées, blende (ou sphalérite) et wurtzite ; d'autre part, les variétés oxydées, smithsonite, hydrozincite (carbonates), franklinite, zincite (oxydes), hémimorphite (ou calamine), willemite (silicates). La blende (ZnS) représente 95 p. 100 de la production minière.
Les teneurs en zinc du minerai varient de 4 à 20 p. 100. Le minerai sous forme de blende est enrichi par flottation. Les minerais oxydés, qui se prêtent mal à la flottation, sont moins exploités.
Grillage des minerais
Les minerais concentrés sont le plus souvent des blendes contenant de 28 à 32 p. 100 de soufre. Il est nécessaire de transformer le sulfure en oxyde par un grillage :


Le grillage s'effectue dans un four spécialement conçu ; on a utilisé successivement les fours Delplace, les fours Spirlet, les fours Wedge, les fours Flash et les fours à lit fluidisé.
Dans les fours à lit fluidisé, le minerai est maintenu en suspension par l'air de grillage soufflé par le bas à un débit convenable. Dans certaines conditions, le lit de minerai en suspension se comporte comme un fluide ; le contact air-particules de minerai est excellent, ce qui favorise la rapidité d'oxydation des sulfures. L'alimentation peut être constituée par du minerai fin ou granulé, la granulation permettant d'éviter un entraînement de poussière important. Cette technique s'est développée rapidement et tend à remplacer les autres procédés. Le minerai grillé obtenu convient très bien au procédé d'extraction par voie hydrométallurgique qui est, de loin, le plus utilisé actuellement. La granulométrie du concentré grillé garde sa finesse initiale, ce qui est favorable à sa dissolution ultérieure. La teneur en soufre résiduel, principalement sous forme de sulfate, est de 1 à 2 p. 100, ce qui n'est pas gênant pour ce genre de traitement.
Lorsque le zinc est obtenu par voie pyrométallurgique (cf. Réduction du minerai grillé), la teneur résiduelle en soufre doit être très faible, ce qui nécessite un chauffage à température plus élevée, de 1 000 0C à 1 200 0C. Le grillage est alors réalisé sur des machines Dwight et Lloyd, qui se présentent sous forme d'une bande sans fin de chariots mobiles munis de grilles, glissant sur des caissons étanches. L'air est soufflé à travers les grilles. La réaction de grillage étant très exothermique, afin de maintenir une température comprise entre 1 000 et 1 200 0C, du minerai déjà grillé est ajouté au minerai à griller. La teneur en soufre du minerai grillé est inférieure à 0,5 p. 100. La température atteinte permet un frittage partiel du concentré grillé ce qui améliore sa résistance à l'écrasement, indispensable à une réduction par voie pyrométallurgique dans un four de type haut fourneau. La haute température à laquelle est porté le concentré permet la volatilisation d'une grande partie du cadmium initialement contenu dans le minerai. Le cadmium est récupéré, sous forme de poussières, au cours de la purification des gaz de grillage et sert de matière première à la métallurgie de ce métal.
Réduction du minerai grillé
La métallurgie du zinc repose sur deux groupes de procédés :
– l'extraction par voie sèche ou voie thermique, appelée plus souvent voie pyrométallurgique, dans laquelle l'oxyde de zinc est réduit en présence de carbone à haute température ;
– l'extraction par voie humide, appelée plus souvent voie hydrométallurgique, dans laquelle l'oxyde de zinc est mis en solution dans l'acide sulfurique dilué, et le zinc extrait par électrolyse. Ce dernier procédé est employé pour près de 90 p. 100 du zinc de première fusion produit dans le monde.
Extraction par voie pyrométallurgique
Principe
La réduction peut être représentée par les deux réactions suivantes :

Les températures vont de 1 100 à 1 300 0C. La vitesse globale de réduction est déterminée par la vitesse de diffusion et d'écoulement des gaz entre les points de réaction avec les constituants solides. De ce fait, la dimension et la porosité des grains de minerai et de charbon influent sur la vitesse globale de réduction.
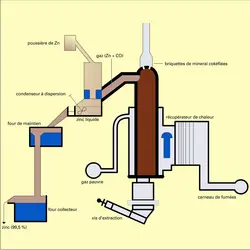
La condensation effectuée à 500 0C environ donne du zinc liquide. Les gaz sortant du condenseur sont saturés en vapeur de zinc. Leur refroidissement fournit de la poudre, le « gris de zinc », qui représente de 2 à 8 p. 100 de la production.
Le cadmium, très volatil, se retrouve intégralement dans le zinc et la poussière de zinc produits. Le plomb, moins volatil, se partage entre les résidus et le zinc condensé.
Fours utilisés
Les fours à creusets horizontaux sont en voie de disparition. Le four New Jersey à creuset vertical est un procédé en continu. Un mélange, constitué de minerais grillés et supergrillés, de charbon cokéfiant, d'argile agglomérante et de liant liquide, est aggloméré en forme de briquettes cuites à 850 0C environ. Au cours de cette cuisson, le charbon bitumineux se transforme en coke et donne une solidité exceptionnelle à la briquette. Les briquettes chaudes sont chargées en haut du four et descendent lentement vers le bas du creuset.
La réduction s'effectue dans des creusets en carbure de silicium de forme parallélépipédique, hauts d'environ 11 mètres et placés dans une chambre de chauffe. Le gaz de combustion est introduit en haut de la chambre et circule vers le bas ; il est brûlé progressivement par l'introduction d'air de place en place.
La température de la chambre est maintenue entre 1 280 et 1 320 0C. Le mélange de vapeur de zinc et d'oxyde de carbone suit une marche ascendante. Les vapeurs sont dirigées, à l'aide d'un conduit en réfractaire, au condenseur qui est maintenu à 500 0C.
Un creuset peut produire jusqu'à 10 tonnes de zinc par jour. Les creusets sont groupés les uns à côté des autres en batteries de dix environ.
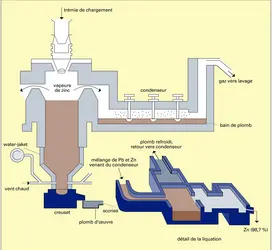
Dans le procédé du haut fourneau, ou procédé de l'Imperial Smelting, le four est alimenté par le gueulard en minerai grillé, aggloméré, coke et produits fondants. L'air est injecté par les tuyères à la base du four, à la température de 700 à 750 0C, et provoque la combustion du coke en fournissant les calories nécessaires pour la réduction de l'oxyde de zinc et la fusion de la gangue. Les gaz produits contenant les vapeurs de zinc sont dirigés dans deux condenseurs symétriques, où ils sont refroidis par une pluie de plomb à 450 0C. Le zinc condensé forme un alliage qui est envoyé dans un système de refroidissement où il se sépare en deux phases, l'une riche en plomb qui est recyclée dans le condenseur, l'autre riche en zinc contenant de 1,50 à 2 p. 100 de plomb. Ce zinc impur doit être raffiné avant son utilisation.
Ce type de four peut traiter des minerais mixtes zinc-plomb.
Extraction par voie hydrométallurgique
Elle se déroule en quatre étapes successives : le concentré grillé est dissous dans l'acide sulfurique, les ions ferriques sont éliminés par précipitation en augmentant le pH, les autres ions métalliques présents sont éliminés par cémentation et, enfin, le zinc est obtenu par électrolyse de la solution purifiée. L'acide est régénéré lors de l'électrolyse et recyclé en amont de la dissolution.
Le concentré grillé est attaqué par une solution diluée à 180-190 grammes par litre d'acide sulfurique. Cette attaque est appelée lixiviation neutre. La dissolution est effectuée vers 55-65 0C, la chaleur étant apportée par la dissolution des oxydes. L'oxyde de zinc passe en solution selon la réaction : ZnO + 2 H+ + SO42— → Zn2+ + SO42— + H2O.
Les autres oxydes métalliques présents dans le concentré grillé passent également en solution sauf l'oxyde de plomb, qui donne du sulfate de plomb très peu soluble. Les métaux précieux, argent et or, sont insolubles ainsi que, en général, la gangue. La dissolution de l'oxyde de zinc et des autres oxydes se traduit par une consommation d'acide et donc par une augmentation de pH. Cette dissolution dure de 1 à 4 heures, et de 75 à 90 p. 100 du zinc passe en solution. Le zinc qui reste insoluble est celui qui, lors du grillage, a formé, avec l'oxyde ferrique, des ferrites insolubles dans ce milieu. Ce zinc est récupéré par une opération complémentaire. Lors de la lixiviation neutre, le milieu est rendu oxydant par injection d'air ou de dioxygène ou par ajout de dioxyde de manganèse afin, principalement, d'oxyder les ions Fe2+, éventuellement présents, en ions Fe3+. La solution passe, de façon continue, de cuve en cuve, le pH de la solution augmentant progressivement, par ajout de concentré grillé, pour atteindre une valeur de 5 dans la dernière cuve. À ce niveau de pH, l'hydroxyde ferrique est totalement précipité. Une décantation permet de séparer la solution des résidus insolubles.
Le résidu solide peut contenir, si le minerai de départ est riche en fer, une part importante du zinc initialement présent dans le minerai. Il est nécessaire de récupérer ce zinc en attaquant ce résidu, à chaud, vers 90-95 0C, par la solution d'acide sulfurique provenant de l'électrolyse. Dans ces conditions, la ferrite est dissoute et les ions contenus, Fe3+ et Zn2+, passent en solution. Cette opération est appelée lixiviation acide. La solution issue de la lixiviation acide réintègre le circuit de traitement, en amont de la « lixiviation neutre ». Toute la difficulté de l'hydrométallurgie du zinc réside, pour les minerais riches en fer, ce qui est le cas de ceux actuellement exploités, dans l'élimination des ions ferriques. En effet, par élévation de pH, l'hydroxyde ferrique Fe(OH)3 précipite. Celui-ci peut être séparé d'une solution par décantation : c'est ce qui se produit lors de la « lixiviation neutre ». Mais, si on souhaite, et cela est le cas industriellement, récupérer au maximum les ions Zn2+ de la solution, il est nécessaire de filtrer et de laver le précipité. Or l'hydroxyde ferrique est très difficile, sinon impossible industriellement, à filtrer. Pour résoudre cette difficulté, plusieurs procédés sont utilisés, le plus employé étant celui dit « à la jarosite », les jarosites formant une famille de composés de formule Fe6(OH)12(SO4)4M2 avec M = Na+, K+, NH4+, Ag+, H3O+... Pour former une jarosite, on peut ajouter, à la solution contenant les ions Fe3+ à éliminer, du sulfate d'ammonium, à chaud, vers 90 0C, et à pH 5 (l'augmentation de pH étant obtenue par ajout de concentré grillé). La jarosite précipite sous forme d'un solide facilement filtrable selon la réaction suivante : 4 SO42— + 6 Fe3+ + 2 NH4+ + 12 H2O → Fe6(OH)12(SO4)4(NH4)2 + 12 H+
En même temps que les ions ferriques, les éléments suivants sont éliminés par précipitation des hydroxydes : Al, Ga, In, Sb, Sn, As et Ge.
Après lixiviation, dans la solution, outre Zn2+, les ions suivants sont encore présents : Cu2+, Cd2+, Ni2+, Co2+, Mn2+. L'élimination de la plupart d'entre eux est effectuée par réduction à l'aide de poudre de zinc. L'emploi de zinc permet d'éviter l'introduction d'ions étrangers. Les ions Mn2+, non réduits, resteront en solution, mais, en revanche, les autres ions seront réduits selon la réaction (M = Cu, Cd, Ni, Co) : Zn + M2+ → Zn2+ + M.
Les ions Cu2+ et Cd2+ sont très facilement réduits, cela est plus difficile pour Ni2+ et Co2+ qui demandent la présence d'activateurs et une température de 75 à 95 0C. Ces métaux se déposent sur les particules de zinc, d'environ 30 micromètres de diamètre. La quantité de zinc utilisée en excès dépend de la teneur en impuretés, elle varie de 16 à plus de 100 kilogrammes par tonne de zinc produit. Cette opération de purification, appelée cémentation, dure plusieurs heures (de 1 à 8 heures). Une filtration sur toile très fine permet de récupérer les particules de zinc enrobées par les métaux déposés. Ce solide, appelé cément, est traité afin de récupérer les métaux contenus et en particulier le zinc en excès. La teneur finale de la solution est, en général, pour chacun des ions Cu2+, Cd2+ Ni2+ et Co2+ inférieure à 0,5 milligramme par litre. La solution de Zn2+ est ainsi purifiée des éléments susceptibles de se déposer, par électrolyse, en même temps que le zinc.
L'électrolyse est réalisée vers 30 à 40 0C. La solution contient initialement de 125 à 170 grammes par litre de Zn2+. Les anodes sont en plomb (alliage contenant de 0,5 à 1 p. 100 d'argent), inattaquable en milieu sulfurique, les cathodes sont en aluminium. La tension est comprise entre 3,2 et 3,7 V, avec une densité de courant de 400 à 700 A par mètre carré. L'intensité atteint jusqu'à 115 000 A. Le zinc se dépose sur la cathode, d'où il est décollé toutes les 24, 48 ou 72 heures par pelage (ou stripping). La production, par cellule qui contient jusqu'à 86 cathodes de 1,6 mètre carré, peut atteindre 3 tonnes par jour. La consommation d'énergie est de 3 000 à 3 500 kWh par tonne de zinc produit. Le zinc obtenu très pur (99,995 p. 100), contient moins de 50 parties par millions d'impuretés, la principale étant le plomb. Il n'a pas besoin de subir un raffinage ultérieur. Les ions Mn2+ qui restent dans la solution s'oxydent en MnO2 sur l'anode en plomb. La solution, après épuisement partiel (aux deux tiers) des ions Zn2+ et régénération de l'acide à l'anode, avec dégagement de dioxygène, est recyclée en amont des lixiviations neutre et acide.
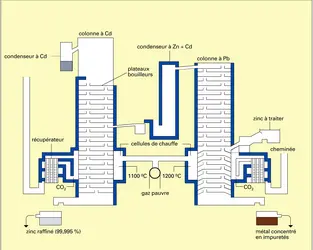
Raffinage du zinc
Le raffinage par liquation limite la teneur en plomb et en fer des zincs thermiques. Le bas point d'ébullition du zinc par rapport à ceux de ses impuretés rend possible la purification du métal par distillation. Le procédé le plus répandu est celui de la New Jersey Company, qui utilise des colonnes à plateaux en carbure de silicium. Ce procédé comporte deux phases : distillation de la plus grande partie du zinc, ce qui le sépare des impuretés moins volatiles (surtout le plomb), puis envoi du zinc obtenu dans une autre colonne, où il est recueilli pour être lingoté. Il permet d'obtenir un zinc extra-pur titrant jusqu'à 99,993.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Noël DREULLE : directeur de recherche au Centre technique du zinc
- Paule DREULLE : chef des laboratoires de recherche et de contrôles de la Compagnie royale asturienne des mines
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
- Bernard WOJCIEKOWSKI : responsable zinc information de l'Union minière France
Classification
Médias
Autres références
-
BLENDE ou SPHALÉRITE
- Écrit par Yves GAUTIER
- 468 mots
-
CADMIUM
- Écrit par Alexandre TRICOT
- 8 051 mots
- 6 médias
Par ses propriétés chimiques et celles de ses composés, le cadmium a beaucoup de similitude avec le zinc. Ce dernier le déplace de ses sels :
-
CARBONATES
- Écrit par Marc DARDENNE et André JAUZEIN
- 5 052 mots
- 12 médias
...forme du rhomboèdre ou du scalénoèdre. Le fer ferreux, le manganèse, le calcium, le magnésium, le cadmium peuvent se substituer en petites quantités au zinc. La couleur est variable : blanc, brun, vert, bleu, rose ou incolore. L'effervescence avec l'acide chlorhydrique à froid, la densité élevée (4,45)... -
CONGO RÉPUBLIQUE DÉMOCRATIQUE DU
- Écrit par Encyclopædia Universalis , Jules GÉRARD-LIBOIS , Henri NICOLAÏ , Patrick QUANTIN , Benoît VERHAEGEN et Crawford YOUNG
- 24 923 mots
- 13 médias
...Maniema et du Katanga septentrional, le cuivre surtout (et les minéraux qui lui sont souvent associés comme le cobalt, le cadmium, l'uranium et le zinc) dans le sud du Katanga, le manganèse enfin, dans le sud-ouest de cette dernière province. Les terrains sédimentaires de la partie centrale sont... - Afficher les 18 références
Voir aussi
- RAFFINAGE, métallurgie
- SULFURE DE ZINC
- HYDROMÉTALLURGIE
- EAU, physico-chimie
- HAUT-FOURNEAU
- EXTRACTION, métallurgie
- ACIER, technologie
- PRÉCIPITATION, chimie
- PURIFICATION, physico-chimie
- SURFACE TRAITEMENTS DE
- OXYDATION
- OXYDE DE ZINC
- RÉSISTANCE À LA CORROSION
- DÉSULFURATION
- FOURS
- GRILLAGE DES MINERAIS
- SHERARDISATION
- ZINCAGE
- GALVANISATION, métallurgie
- CÉMENTATION
- ZAMAK
- SULFATE DE ZINC
- MÉTALLISATION
- JAROSITE
- RÉDUCTION, chimie
- CHLORURES
- ÉLECTROLYSE
- REVÊTEMENT MÉTALLIQUE