GAZ PARFAITS LOI DES
Articles
-
AIR
- Écrit par Jean PERROTEY
- 2 155 mots
- 2 médias
De façon générale, l'air répond approximativement aux lois des gaz parfaits. Il suit en particulier la loi de Boyle-Mariotte, sa pression à température constante étant inversement proportionnelle à son volume. -
ATMOSPHÈRE - La couche atmosphérique terrestre
- Écrit par Jean-Pierre CHALON
- 7 817 mots
- 7 médias
...volumique (ou masse par unité de volume) de l’air correspond à la masse de l’ensemble des molécules présentes, dans un volume unité (1 m3). Dans le cas d’un gaz parfait, la masse volumique (ρ en kg.m-3) est reliée à la pression et à la température suivant l’équation ρ = p/R.T, où p est la pression... -
ATMOSPHÈRE - Thermodynamique
- Écrit par Jean-Pierre CHALON
- 7 607 mots
- 7 médias
...très espacées les unes des autres et que leurs interactions restent négligeables, l’air contenu dans une parcelle a un comportement proche de celui des gaz parfaits. On peut en déduire qu’en première approximation ses principales variables d’état restent liées par une équation du type p = ρ... -
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
...l'échelle thermométrique ; mais des vapeurs, tel l'anhydride carbonique dont la liquéfaction est plus aisée, s'écartent davantage du modèle théorique des « gaz parfaits » que définissent ces lois. Néanmoins, tous les gaz manifestent (avec les solutions diluées) par rapport aux autres états de la matière une... -
CINÉTIQUE DES FLUIDES THÉORIE
- Écrit par Jean-Loup DELCROIX
- 9 806 mots
- 15 médias
...suppose que la paroi est parfaitement plane et que les molécules rebondissent élastiquement sur celle-ci, on trouve que la force est normale à la paroi et, dans le cas simple d'un gaz dilué en équilibre thermodynamique à la température T, le calcul conduit, pour la pression p, à la loi des gaz parfaits :
-
MATIÈRE (physique) - État gazeux
- Écrit par Henri DUBOST et Jean-Marie FLAUD
- 8 135 mots
- 7 médias
...moyenne de la pression (p̄) vaut donc :En utilisant l'égalité mv2qm = 3KBT et en introduisant la quantité R = KB . NA = 8,314 41 Jmol—1K—1, constante indépendante de la nature du gaz et appelée constante des gaz parfaits, on obtient l'équation d'état des gaz parfaits : [PV = nRT].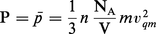
-
MATIÈRE (physique) - Plasmas
- Écrit par Patrick MORA
- 7 620 mots
- 4 médias
À suffisamment haute température (T), le plasma est totalement ionisé etpeut en général être considéré comme un gaz parfait, où chaque particule a une énergie cinétique moyenne égale à 3/2(kBT) et dont l'équation d'état s'écrit P = nkBT, (P étant la pression et ... -
STATISTIQUE MÉCANIQUE
- Écrit par Berni J. ALDER et Bernard JANCOVICI
- 5 855 mots
- 8 médias
...L'application de la mécanique statistique aux gaz est décrite dans cet ouvrage (cf. état gazeux). On notera seulement ici que, à partir de la température T définie en mécanique statistique par (6) et (7), on trouve pour l'équation d'état d'un gaz parfait composé de N molécules la loi bien connue :
-
THERMODYNAMIQUE - Lois fondamentales
- Écrit par Paul GLANSDORFF et Ilya PRIGOGINE
- 3 690 mots
- 5 médias
... sont donc aussi des fonctions d'état. Elles dépendent en général de la température, de la pression et de la composition du système. Pour un gaz parfait à un seul constituant, Cp et CV ne dépendent que de la température (loi de Joule). Au point de vue macroscopique, un gaz parfait est défini... -
VAN DER WAALS FORCES DE
- Écrit par Bernard PIRE
- 496 mots
Le physicien néerlandais Johannes Diderik Van der Waals (1837-1923) eut un parcours universitaire si atypique qu’il ne put passer son doctorat qu’à l’âge de trente-six ans, en 1873. Sa thèse intitulée De la continuité des états liquides et gazeux est vite remarquée par de nombreux physiciens,...
-
VIDE TECHNIQUE DU
- Écrit par Pierre AILLOUD
- 6 400 mots
- 5 médias
Lorsque N molécules degaz parfait sont enfermées dans un réservoir de volume V, la pression p est donnée par l'équation d'état pV = NkT, avec p exprimé en pascals (Pa), V en mètres cubes (m3) et T, la température, en kelvins (K) ; k est la constante de Boltzmann et vaut 1,38 × 10...

