DIPOLAIRES MOMENTS
Articles
-
DIPOLAIRES MOMENTS
- Écrit par Jean BARRIOL
- 4 732 mots
- 8 médias
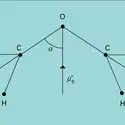
Lorsque, dans une molécule ou dans une liaison chimique, les barycentres des charges électriques positives et négatives ne coïncident pas, la juxtaposition de ces charges opposées porte le nom de dipôle électrique. On dit encore que la molécule ou la liaison possède un moment dipolaire. Ce moment est...
-
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 237 mots
...sont inégalement distribués parmi les atomes dans les molécules, de sorte que celles-ci peuvent être considérées comme des dipôles électriques permanents. Debye put expliciter la liaison entre structure moléculaire et moment dipolaire (produit de la charge par la distance constante entre les pôles). -
FERRO-ÉLECTRICITÉ
- Écrit par Lucien GODEFROY
- 2 836 mots
- 3 médias
Les corps ferro-électriques sont une classe de diélectriques solides, dont l'étude s'est développée depuis 1945. L'intérêt de ces matériaux n'est pas seulement théorique ; leur très grande constante diélectrique, leurs propriétés non linéaires, tant électriques qu'optiques, sont exploitées dans de...
-
INTERACTIONS (physique) - Électromagnétisme
- Écrit par Bernard DIU
- 4 448 mots
- 6 médias
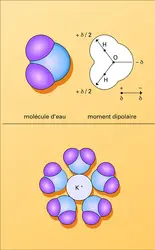
Deux charges opposées localisées en des points distincts constituent un dipôle électrique.Les molécules d'eau H2O et d'ammoniac NH3 sont ainsi dipolaires : les électrons qui assurent dans ces molécules les liaisons covalentes sont (partiellement) repoussés par les H, « électropositifs... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 250 mots
- 7 médias
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule. -
LIAISONS CHIMIQUES - Liaison hydrogène
- Écrit par André JULG
- 3 328 mots
- 2 médias
...l'association des édifices A–H et B s'interprète par l'interaction électrostatique entre ceux-ci. La paire libre portée par le groupement B constitue un dipôle orienté du noyau vers H. Si la liaison A–H est polarisée dans le sens A- H+, elle sera attirée par le dipôle porté par B. De plus, sous l'effet... -
LIAISONS CHIMIQUES - Liaisons biochimiques faibles
- Écrit par Antoine DANCHIN
- 5 901 mots
- 9 médias
...d'électrons que les atomes d'hydrogène. On trouve donc localement un excès de charges négatives au voisinage des noyaux d'oxygène. Cette disposition forme un dipôle électrique et entraîne que les molécules voisines tendent à s'orienter les unes par rapport aux autres, les charges de signe contraire s'attirant.... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 631 mots
- 12 médias
...instant, le centre du nuage d'électrons ne se confond pas avec celui du noyau ; l'atome de néon se comporte donc comme un dipôle électrique dont le vecteur moment dipolaire varie au cours du temps, en ayant une valeur moyenne nulle. Un atome de néon voisin va être sensible au champ électrique créé par le... -
MATIÈRE (physique) - État gazeux
- Écrit par Henri DUBOST et Jean-Marie FLAUD
- 8 135 mots
- 7 médias
...neutre. En revanche, les moments d'ordre supérieur ne le sont pas nécessairement et leur grandeur dépend de la symétrie de la distribution de charges. Le moment dipolairese mesure en debye (D) (1D = 3,335 64 × 10—30 C.m). Les molécules polaires telles que HCl, H2O, NH3, SO2... possèdent un moment...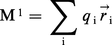
-
SOLVANTS
- Écrit par Jacques DEVYNCK
- 1 796 mots
- 1 média
Les solvants moléculaires sont généralement classés à partir de la valeur de leur constante diélectrique (ε) et du moment dipolaire de leur molécule (μ) qui définissent à la fois la nature des espèces susceptibles de s'y dissoudre et les modes d'interaction soluté-solvant.
Médias