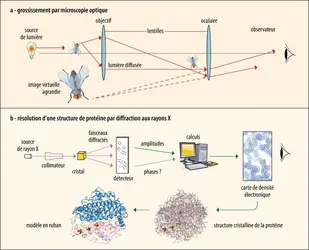
Détermination d’une structure 3D par diffraction des rayons X
carte de densité : P. Emsley et al./ University of California - CC-BY ; modèles : J.-C. Fontecilla-Camps/ Institut de biologie structurale ; adaptation : EUF
La détermination de la structure 3D d'une protéine par diffraction aux rayons X peut être comparée au grossissement d'un échantillon (ici une mouche) par microscopie optique (en haut). La source lumineuse conventionnelle est remplacée par des rayons X. Au lieu de dévier la lumière qui a traversé l'échantillon par des lentilles pour générer l'image, les taches obtenues par les rayons X diffractés par les molécules de protéine dans le cristal sont traitées par un logiciel afin d'obtenir une carte de leur densité électronique. À partir de cette carte (en bas à droite), on peut construire un modèle tridimensionnel de la protéine, ici l'enzyme hydrogénase de la bactérie Desulfovibrio gigas. Ce modèle inclut tous les atomes de la protéine, sauf les hydrogènes. Des agrégats de fer et soufre (sphères rouges et jaunes), qui transportent les électrons résultant de la réaction, et des atomes de fer et de nickel (sphères rouges et vertes), qui constituent le site actif de l'enzyme, sont aussi représentés. En bas à gauche, le modèle du repliement de la chaîne principale de la protéine met en évidence des éléments de structures secondaires, en particulier des hélices.