Détermination d’une structure tridimensionnelle par résonance magnétique nucléaire
images et conception : B Bersch/ Institut de biologie structurale ; adaptation : EUF
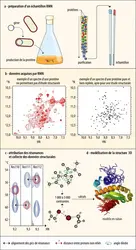
Le panneau supérieur (a) montre la préparation d'un échantillon pour la RMN. La protéine à étudier est produite par voie biotechnologique à partir d'une copie du gène insérée dans un plasmide, petit bout d'ADN circulaire. Ce plasmide est ensuite introduit dans la bactérie Escherichia coli, utilisée pour la production et cultivée ici dans un milieu enrichi en 15N et 13C pour le marquage isotopique de la protéine. Après purification (symbolisée par une colonne de chromatographie), un échantillon RMN est préparé dans des tubes et les premières données sont acquises (panneau b). L'allure du spectre de RMN obtenu renseigne sur la faisabilité de l'étude. Un échantillon de bonne qualité se caractérise par un spectre dans lequel les signaux sont bien séparés et caractérisés par des intensités et largeurs homogènes. Pour améliorer la qualité du spectre, les procédures (en a) peuvent être modifiées. Une fois les conditions expérimentales optimisées, des spectres multidimensionnels (avec 2 ou 3 axes de fréquences) sont enregistrés pour l'attribution des résonances aux différents noyaux présents dans la protéine, puis la collecte des données structurales (panneau c). Ces données (des distances interatomiques, des angles dièdres...) sont utilisées comme contraintes pour la modélisation de structures 3D, et un ensemble de structures compatibles avec ces données est obtenu (panneau d). Un tel ensemble comportant 20 structures est montré dans une représentation dite de ruban (seule la chaîne principale est visualisée en surlignant la présence d'hélices et de feuillets).