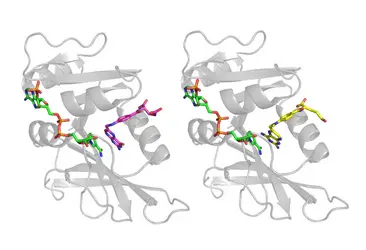
L’enzyme dihydrofolate réductase complexée à son substrat, l’acide dihydrofolique, et son inhibiteur, le méthotrexate
Christophe Leger ; Bystroff et al./ PDB ; Filman et al./PDB
À gauche : complexe ternaire de l'enzyme dihydrofolate réductase (DHR) et de ses substrats : le nicotinamide adénine dinucléotide phosphate (NADPH, dont les atomes de carbone sont colorés en vert, ceux d'azote en bleu, d'oxygène en rouge, de phosphore en orange) et l'acide dihydrofolique (atomes de carbone colorés en violet). Le squelette de l'enzyme est dessiné avec un ruban qui indique les éléments de structure secondaire. Le positionnement relatif du nucléotide et de l'acide dihydrofolique permet le transfert d'hydrure entre ces deux substrats. À droite : structure du même complexe en présence du méthotrexate (coloré en jaune), montrant que cet inhibiteur compétitif se lie à l'enzyme de la même façon que l'acide dihydrofolique, dont la structure est très similaire. (D'après modèles 7DFR et 3DFR de la Protein Data Bank)